赵劲课题组在光激活萤火虫萤光素酶方面取得重要进展
随着光遗传的发展,利用光对蛋白质活性的时空调控成为了一个新的研究方向。最近,北京大学深圳研究生院赵劲老师课题组和北京大学化学与分子工程学院陈鹏老师课题组共同合作,在美国化学会刊Journal of the American Chemical Society在线发表了名为 《Mechanism-Based Design of a Photoactivatable Firefly Luciferase》的科研论文(http://pubs.acs.org/doi/abs/10.1021/ja4013535),报道了他们利用光保护的赖氨酸类似物(ONBK)开发了一种基于机理的光激活萤光素酶,并用于检测活细胞内ATP的动态变化。
萤火虫萤光素酶报告体系是一种被广泛应用于生物医学研究的一种报告体系。在ATP和氧气的参与下,萤光素酶可以氧化萤光素,产生高亮度的生物萤光。由于萤光素酶报告体系能够提供高灵敏,低背景的检测结果,所以这个检测体系在研究细胞,活体组织和动物的生命活动过程和基因表达中有着重要的应用。萤光素酶也可以用于检测环境或细胞内的ATP浓度,但是对活细胞内的ATP动态变化的检测有一定的难度。为此,赵劲老师课题组和陈鹏老师课题组共同合作开发了基于非天然氨基酸的光控萤光素酶体系,并成功用于检测活细胞内ATP的动态变化。
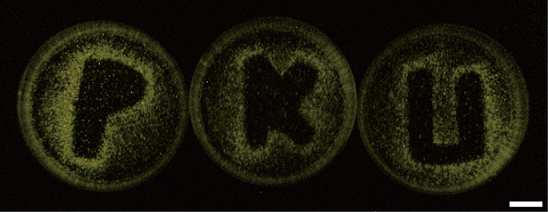
萤火虫萤光素酶中529位的赖氨酸残基在萤光素酶催化发光过程中起到了重要的作用,利用光保护的赖氨酸类似物(ONBK)替代这个重要的赖氨酸残基,可以使萤光素酶完全失去酶活。再利用低强度的紫外光(365nm)照射进行脱保护重新生成自由的赖氨酸残基,恢复萤光素酶的活性。这种方法可以对萤光素酶的活性进行时空调控,并且这种低强度的光照不会对细胞产生损害。将这种光控萤光素酶表达在活细胞的细胞质中并用低强度紫外进行光照,可以对活细胞内的ATP浓度随时间的变化进行检测。
该工作由北京大学深圳研究生院2010级博士生赵镜一同学和北京大学化学与分子工程学院博士生林世贤同学合作完成。