周强团队揭示前额叶皮层PV神经元亚群在高级执行功能中的不同分工
时间:2025-07-16
前额叶皮层(prefrontal cortex,PFC)中的抑制性信号在生理功能和精神疾病病理中起着非常重要的作用[1-4]。小清蛋白(parvalbumin,PV)神经元以其快速放电表型、低输入电阻、快速和高幅后超极化以及对压力的易感性等特性,在不同的认知与执行功能中发挥着关键作用[5, 6]。PV神经元的功能障碍与多种精神疾病及神经退行性疾病密切相关[7, 8],例如PFC中PV神经元在恐惧记忆相关学习[9-11]、工作记忆(working memory, WM)[12, 13]及焦虑样行为[8, 14, 15]等中都发挥着关键作用。然而,参与不同功能的PV神经元是否属于不同亚群尚不清楚。这一问题的解答不仅有助于深入理解PV神经元及抑制性神经元的基本特性与功能,也对揭示疾病状态下功能障碍共现的机制及精准治疗的相应靶点具有重要意义。
近日,北京大学深圳研究生院化学生物学与生物技术学院周强课题组在Neuropsychopharmacology期刊发表题为“Distinct Subpopulations of Parvalbumin Neurons Participating in Divergent Prefrontal Functions”的研究论文。博士研究生胡烨弘为论文第一作者,周强教授为通讯作者。该研究分析了小鼠中参与不同条件性恐惧记忆、焦虑样行为和工作记忆的PV神经元空间分布、电生理特性、突触输入特征及不同亚群间的交互作用,阐明了:(1)参与不同恐惧记忆调控的PV神经元为同一亚群神经元;(2)参与恐惧记忆、焦虑样行为和工作记忆的PV神经元分属不同亚群。该研究为前额叶PV神经元的组织模式提供了重要见解,并揭示了不同PV亚群在功能多样性中的独立性与非交互性。

如果两个PV神经元的亚群不尽相同,那么它们可能有以下几个特征:(1)不同/不相重叠的空间分布,(2)不同突触输入和内源性细胞特性,(3)特异性的激活或者抑制与一类行为相关的PV神经元亚群,不会对由另一亚群所参与的行为造成显著影响。
周强课题组先前已发现PFC中PV神经元在条件恐惧记忆相关的安全信号学习(safety learning, SL)[10, 11, 16]和概率性学习(50% probabilistic learning, 50P)[9]中发挥着至关重要的作用。该研究在此基础上,利用活动依赖激活的c-Fos标记首先对参与SL和50P的PV神经元比例做了统计,发现二者比例近似,且重合率高达80%以上(图1 J)。通过活动依赖性标记技术结合光遗传手段,进一步探究了调控其中一种功能的PV神经元是否会影响另一功能,发现参与这两种恐惧记忆调控的效果一致。以上结果阐明参与这两种恐惧记忆调控的dmPFC PV神经元在空间分布上高度重叠,且功能上存在相互影响。
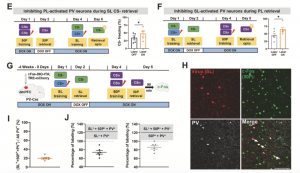
图1. dmPFC中参与两种恐惧记忆调控的PV神经元为同一亚群
研究团队以高架十字迷宫(elevated plus maze, EPM)为行为范式研究小鼠焦虑样行为,通过对参与恐惧记忆的PV神经元进行光遗传抑制,发现这两群PV神经元在功能上不相重叠(图2 A,B)。利用离体脑片电生理技术记录在这两类行为中高度激活而被标记上的PV神经元,发现它们的突触输入存在明显差异(图2D),且二个亚群细胞的特性也存在显著差异(图3)。以上结果阐明恐惧记忆与焦虑调控的PV神经元分属不同亚群。

图2. dmPFC中参与恐惧记忆调控和焦虑样行为的PV神经元具有不同的作用和突触输入

图3. dmPFC中参与恐惧记忆调控和焦虑样行为的PV神经元具有不同的细胞特性
研究团队对参与恐惧记忆和参与工作记忆的PV神经元比例进行统计,发现行为相关的神经元均占PV神经元总数的20%左右,但二者的重合比例并不高(图4E)。此两个亚群的空间分布是否不同呢?对此,研究团队通过对行为标记上的PV神经元空间分布的研究,发现这两个亚群神经元在dmPFC的嘴侧-尾侧轴上存在显著差异(图4G)。参与恐惧记忆的PV神经元更多分布在dmPFC靠近嘴侧的位置,而参与WM的PV神经元更多分布于靠近尾侧区域。参与EPM的PV神经元总量大于参与其它两类行为的PV神经元,且多靠近嘴侧(图4F-H)。
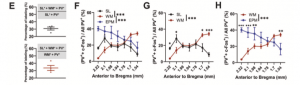
图4. dmPFC中不同行为相关的PV神经元亚群具有不同的空间位置分布
研究团队还检测了与恐惧记忆相关的PV亚群和与工作记忆相关的PV亚群在功能上的交互作用,没有发现显著的相互影响。通过对这两个亚群的离体脑片电生理记录,证明这两个亚群在兴奋性自发突触前电流和自身细胞特性存在一定差异。以上结果阐明了参与恐惧记忆调控的PV神经元和参与工作记忆的PV神经元分属不同亚群。
综上所述,该项研究阐明:(1)dmPFC中介导安全信号学习和概率恐惧学习两个与恐惧记忆相关为同一亚群PV 神经元;(2)参与焦虑、工作记忆和条件恐惧记忆调节的是三个不同的PV亚群,具有不同的空间位置分布、突触输入、内在细胞特性,而且功能层面它们之间不存在显著的相互作用。该研究的发现为PV神经元在特性和功能上的异质性提供了新证据,确定了不同亚群在结构和功能上的差异。研究团队提出了一个精细的PFC微环路模型,其中PV神经元亚群作为特异的抑制模块,可以实现灵活的行为控制。
该项工作提供了一个研究神经元亚群的框架,为神经亚群分型提供了思路、实验方法与案例。dmPFC中三个独立的PV神经元亚群的存在提示特定的亚群功能障碍可能是不同精神疾病的基础,为精神疾病及其共病的深度解析与精准治疗提供了思路。
北京大学深圳研究生院化学生物学与生物技术学院周强教授为该论文通讯作者,博士研究生胡烨弘为第一作者。课题组张鑫洋博士、方梓熙博士等为论文做出了重要贡献。感谢张谨博士、张玉杰博士提供的支持。该研究得到了深圳-香港脑科学研究院-深圳市基础研究机构(2024SHIBS0004)、国家自然科学基金(82204356)、深圳市政府基础研究资助项目(JCYJ20220530160001002)及深圳市儿童医院科研基金(ynkt2021-zz24)等支持。
原文链接:https://www.nature.com/articles/s41386-025-02159-3
参考文献
1.Chen, Q., et al., Dysfunction of cortical GABAergic neurons leads to sensory hyper-reactivity in a Shank3 mouse model of ASD. Nat Neurosci, 2020. 23(4): p. 520-532.
2.Lewis, D.A., Inhibitory neurons in human cortical circuits: substrate for cognitive dysfunction in schizophrenia. Curr Opin Neurobiol, 2014. 26: p. 22-6.
3.Nakazawa, K., et al., GABAergic interneuron origin of schizophrenia pathophysiology. Neuropharmacology, 2012. 62(3): p. 1574-83.
4.Palop, J.J. and L. Mucke, Network abnormalities and interneuron dysfunction in Alzheimer disease. Nat Rev Neurosci, 2016. 17(12): p. 777-792.
5.Ferguson, B.R. and W.J. Gao, PV Interneurons: Critical Regulators of E/I Balance for Prefrontal Cortex-Dependent Behavior and Psychiatric Disorders. Front Neural Circuits, 2018. 12: p. 37.
6.Ruden, J.B., L.L. Dugan, and C. Konradi, Parvalbumin interneuron vulnerability and brain disorders. Neuropsychopharmacology, 2021. 46(2): p. 279-287.
7.Selten, M., H. van Bokhoven, and N. Nadif Kasri, Inhibitory control of the excitatory/inhibitory balance in psychiatric disorders. F1000Res, 2018. 7: p. 23.
8.Page, C.E. and L. Coutellier, Prefrontal excitatory/inhibitory balance in stress and emotional disorders: Evidence for over-inhibition. Neurosci Biobehav Rev, 2019. 105: p. 39-51.
9.Yan, R., et al., Prefrontal inhibition drives formation and dynamic expression of probabilistic Pavlovian fear conditioning. Cell Rep, 2021. 36(6): p. 109503.
10.Yan, R., T. Wang, and Q. Zhou, Elevated dopamine signaling from ventral tegmental area to prefrontal cortical parvalbumin neurons drives conditioned inhibition. Proc Natl Acad Sci U S A, 2019. 116(26): p. 13077-13086.
11.Wang, T., et al., Paraventricular Thalamus Dynamically Modulates Aversive Memory via Tuning Prefrontal Inhibitory Circuitry. J Neurosci, 2023. 43(20): p. 3630-3646.
12.Arime, Y., et al., Activation of prefrontal parvalbumin interneurons ameliorates working memory deficit even under clinically comparable antipsychotic treatment in a mouse model of schizophrenia. Neuropsychopharmacology, 2024. 49(4): p. 720-730.
13.Murray, A.J., et al., Parvalbumin-positive interneurons of the prefrontal cortex support working memory and cognitive flexibility. Sci Rep, 2015. 5: p. 16778.
14.Page, C.E., et al., Prefrontal parvalbumin cells are sensitive to stress and mediate anxiety-related behaviors in female mice. Sci Rep, 2019. 9(1): p. 19772.
15.Shepard, R. and L. Coutellier, Changes in the Prefrontal Glutamatergic and Parvalbumin Systems of Mice Exposed to Unpredictable Chronic Stress. Mol Neurobiol, 2018. 55(3): p. 2591-2602.
16.Wang, Z., Z. Wang, and Q. Zhou, Modulation of learning safety signals by acute stress: paraventricular thalamus and prefrontal inhibition. Neuropsychopharmacology, 2024. 49(6): p. 961-973.

