课题组在RNase L的化学调控及基于片段药物开发领域取得进展
假性激酶-核糖核酸酶RNase L是一个多结构域核酸内切酶,由N端锚定重复域(ANK)结构域、假性激酶(PK)结构域和C端核糖核酸酶(RNase)结构域串联组成的,在细胞内经寡聚腺苷酸2-5A激活,通过剪切病毒和宿主单链RNA发挥抗病毒活性。与此同时,RNase L同时也参与其他多种细胞生理活动,比如细胞自噬、凋亡及炎症小体形成等。在人类遗传病艾卡迪综合征(Aicardi-Goutière syndrome, AGS)中,RNase L被过度激活,引起神经变性和免疫炎症。因此靶向RNase L开发化学小分子调控剂可能为多种免疫相关疾病提供潜在治疗方案。
近期,北京大学深圳研究生院黄昊课题组利用基于片段的药物开发方法(FBDD)针对RNase L进行抑制剂开发,取得成果。首先,通过酶活方法以及饱和转移差谱(STD)-NMR方法筛选并鉴定了13个活性小分子片段,经过对片段和天然产物进行结构对比,衍生获得更高活性的抑制剂分子杨梅素(Myricetin,IC50=~200 μM)和金丝桃苷(Hyperoside, IC50=~2 μM)。本研究使用核磁手段证明了杨梅素和金丝桃苷能够直接与RNase L蛋白相互作用,并通过晶体结构揭示了杨梅素(Myricetin)的结合口袋,其工作机制是通过靶向假性激酶的ATP口袋发挥别构抑制活性。最后,在细胞水平上验证了Myricetin能够有效抑制RNase L的剪切活性(图1)。本文验证了通过靶向核糖核酸酶RNase L的假性激酶结构域开发其别构抑制剂的策略。同时,共晶结构显示,片段AC40357与衍生获得的天然产物Myricetin在RNase L结合口袋内的结合模式一致,提供了一个将化合物片段衍生为天然产物抑制剂的成功例子。
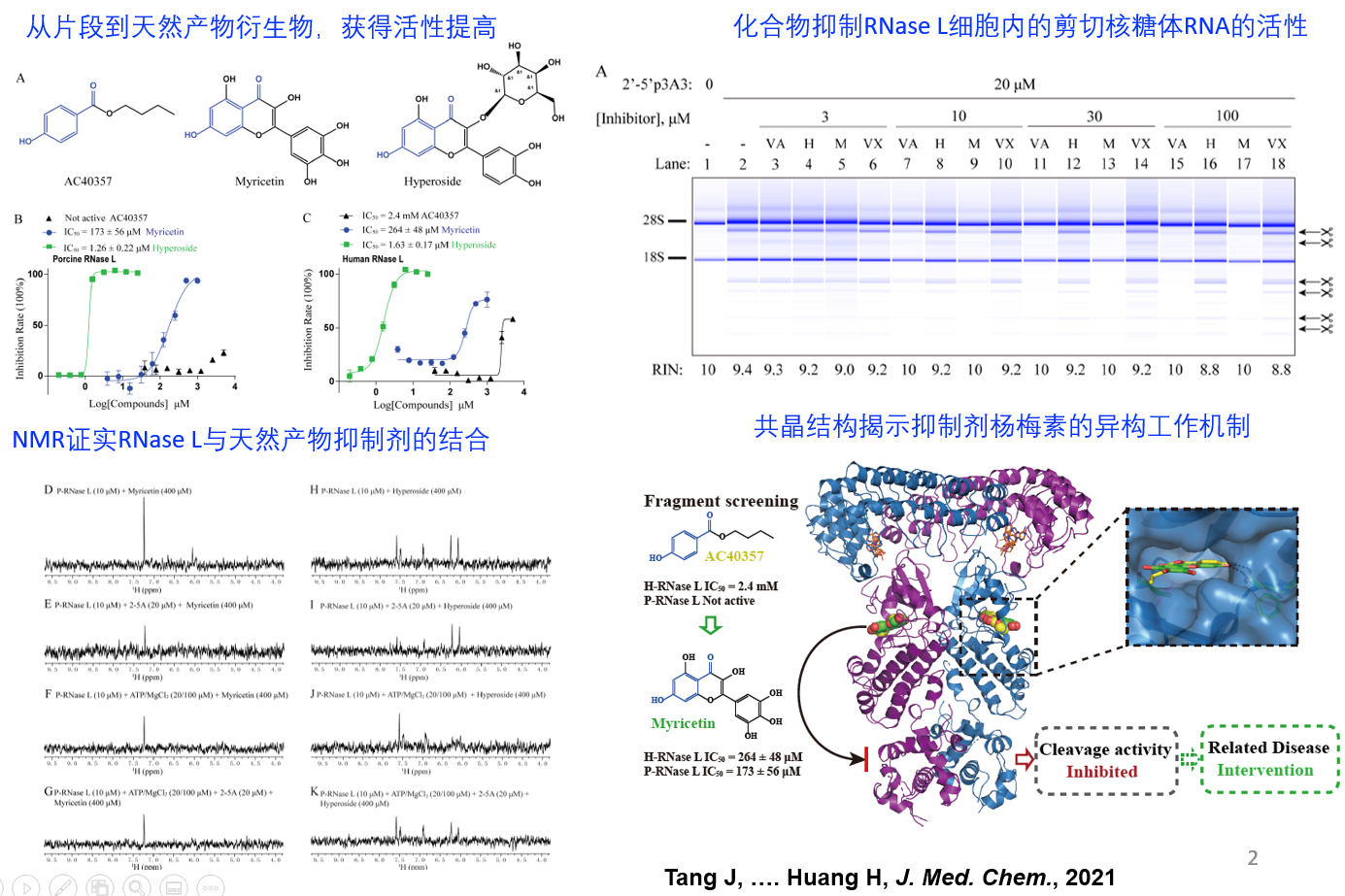
图1. 基于FBDD方法开发RNase L抑制剂及抑制机理研究
该成果以“Identification of Small Molecule Inhibitors of RNase L by Fragment-Based Drug Discovery” 为题,近期发表于药学期刊Journal of Medicinal Chemistry,论文链接https://doi.org/10.1021/acs.jmedchem.1c01156。该研究由黄昊课题组与美国克利夫兰癌症研究中心Robert H. Silverman组合作完成,黄昊教授与Robert H. Silverman 教授为该论文的共同通讯作者;肿瘤化学基因组学省部共建国家重点实验室为第一作者单位。以上工作得到了国家自然科学基金委、深圳市科技创新委员会、美国NIH R01项目的基金的支持。北京大学北京核磁共振中心的牛晓刚博士和上海光源的周欢博士对本文提供了技术支持。
迄今为止,黄昊课题组在RNase L的结构生物机制和化学调控研究领域取得了一系列的重要进展(图2),包括通过晶体衍射首次解析了RNase L的全长二聚体晶体结构(Huang et al. Mol Cell. 2014),揭示了RNase L的抗病毒先天免疫激活机制。2020年,课题组使用生物物理和生物化学等手段解析了抗癌药物激酶抑制剂Sunitinib及其衍生物抑制RNase L的结构机理,提出靶向RNase L假性激酶结构域中的ATP结合口袋,破坏RNase L活性二聚体的稳定性,是别构调节其核糖核酸酶活性的有效方法(Tang et al. Biochem J., 2020)。同年,课题组和加拿大及美国研究团队进行合作,用激酶专属抑制剂库针对RNase L筛选高活性抑制剂,成功筛选并鉴定获得纳摩尔水平抑制活性的抑制剂鞣花酸(Ellagicacid,EA)和瓦隆酸双内酯(Valoneic acid dilactone, VAL)。其中VAL能够逆转ADAR1缺失导致内源双链RNA激活OAS-RNase L系统引起的细胞死亡。该研究为使用小分子抑制剂调控RNase L功能及靶向RNase L治疗AGS奠定基础(Daou et al. PNAS. 2020)。
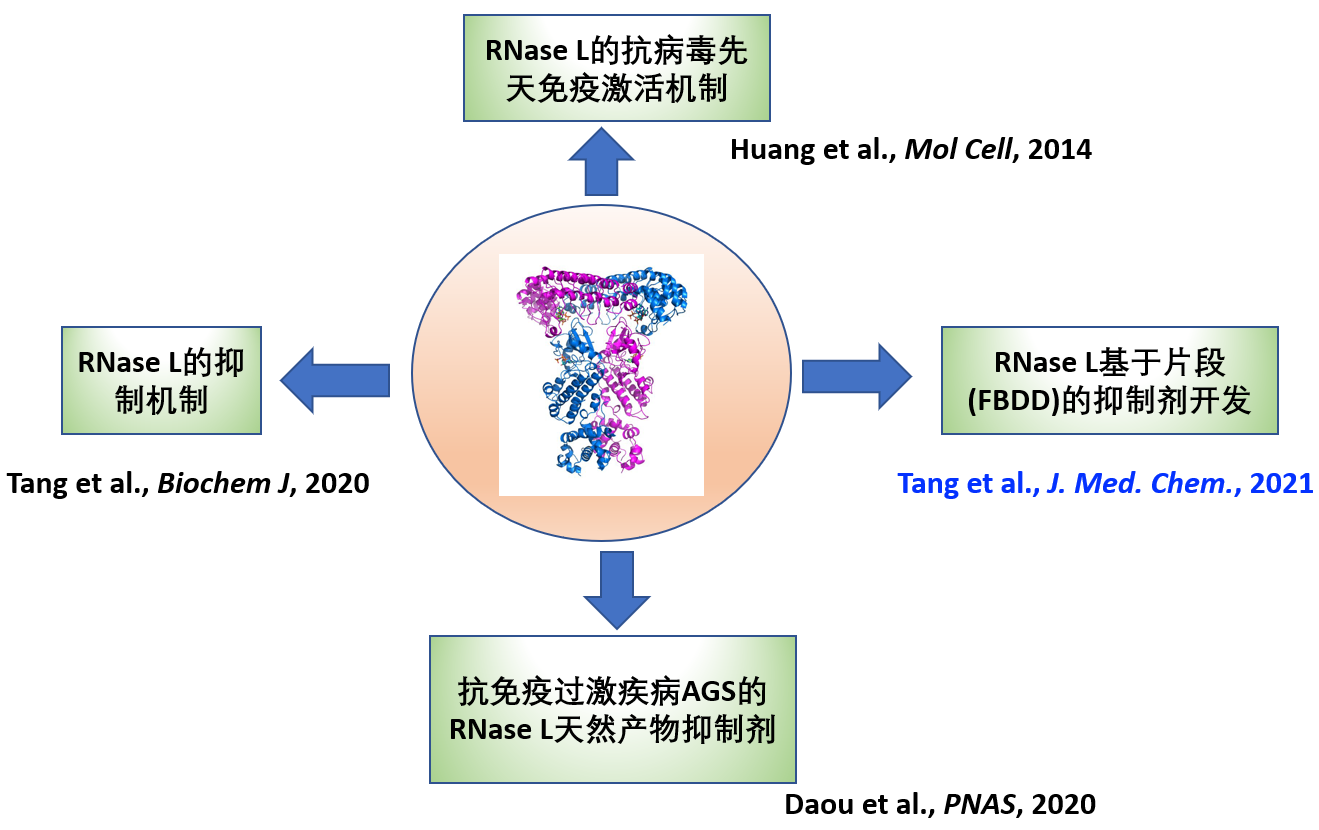
图2. 黄昊课题组在RNase L的结构生物机制研究及其化学调控做出系统工作
参考文献:
Identification of Small Molecule Inhibitors of RNase L by Fragment-Based Drug Discovery.
Jinle Tang#, Beihua Dong#, Ming Liu, Shuyan Liu, Xiaogang Niu, Christina Gaughan, Abhishek Asthana, Huan Zhou, Zhengshuang Xu, Guoliang Zhang, Robert H. Silverman*, Hao Huang*, J. Med. Chem. in press: https://doi.org/10.1021/acs.jmedchem.1c01156
