Angew Chem|北大黄昊团队与合作者开发靶向新冠病毒Mpro新口袋抗病毒抑制剂
新冠病毒 SARS-CoV-2 主蛋白酶 M pro 负责病毒蛋白链的切割,并促进病毒的组装。因此, M pro 是 抗病毒药物研发的关键靶点。目前对 靶向 SARS-CoV-2 M pro 的药物开发 研究 , 主要集中在其 底物结合 口袋 中的 S4-S1’ 位点(例如,辉瑞公司开发的抗新冠药物Paxlovid TM ), 而对 其 S1’-S3’ 位点 的 底物结合选择性以及抗病毒抑制剂开发 研究较少,特别是S1’-S3’ 位点 本身是否可以用于 抗病毒 抑制剂开发还 不 清楚。

图1. 靶向S1’-S3’口袋的新型SARS-CoV-2 Mpro抑制剂的开发
近日,北京大学深圳研究生院/省部共建肿瘤化学基因组学国家重点实验室/深圳湾实验室黄昊团队及许正双副教授,联合深圳市第三人民医院/国家感染性疾病临床医学研究中心张国良团队开发了靶向S1’-S3’位点的新型SARS-CoV-2 Mpro共价抑制剂(图1)。该项研究通过合理设计多肽,利用等温滴定量热法(ITC)方法,探究了SARS-CoV-2 Mpro S1’-S3’位点的底物选择性,其中S1’位点偏好Ala,S2’偏好Lys/Ile,S3’偏好Phe/Trp。作者通过解析多肽/Mpro的晶体结构揭示其底物选择性的分子机制(图2)。结构分析表明,S1’-S3’口袋可以选择性地结合病毒多肽底物,并发现Mpro的S1’-S3’口袋对多肽序列Ala-Ile-Phe (AIF)有较高的亲和力。
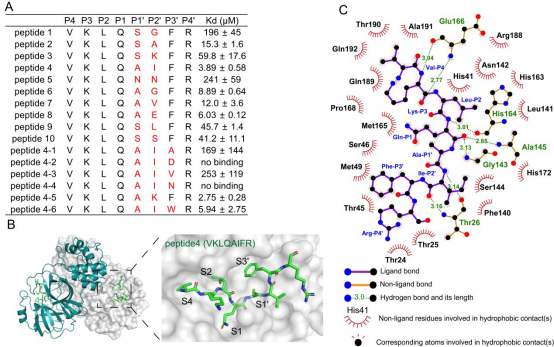
图2. SARS-CoV-2 Mpro S1’-S3’口袋的底物选择性及多肽/Mpro蛋白晶体结构
接下来,作者以多肽序列Ala-Ile-Phe (AIF)序列作为新抑制剂的骨架,在Ala的N-末端引入共价接头。通过测试不同的共价接头发现,含α-卤代乙酰胺型共价接头的化合物对SARS-CoV-2 Mpro具有抑制活性,其中以AIF为骨架,并含溴代乙酰胺共价接头的化合物D-4-38有较好的抑制活性。随后,作者以D-4-38为基础,探究了P3’位置的构效关系。作者解析了Phe(P3’)临位-羟基取代衍生物D-5-96/Mpro的晶体结构,确认了抑制剂与Mpro结合模式。通过优化,最终获得了抑制活性最好的Phe(P3’)临位和对位-甲基双取代化合物D-4-77(IC50 = 0.95 μM,抗病毒EC50 = 0.49 μM)(图3)。
因为Mpro还对宿主细胞的NF-κB先天免疫有抑制作用。作者发现D-4-77能通过抑制Mpro进而恢复宿主NF-κB免疫反应,因此D-4-77除了抑制Mpro对病毒多肽链的剪切,还是对抗SARS-CoV-2导致人体先天免疫反应损伤的的免疫保护剂。

图3. SARS-CoV-2 Mpro抑制剂优化及抑制剂与Mpro结合模式
综上,该项工作探究了SARS-CoV-2 Mpro S1’-S3’口袋的底物选择性,并通过合理设计,开发靶向S1’-S3’口袋的新型共价抑制剂。该研究证明了SARS-CoV-2 Mpro的S1’-S3’口袋可成药性,为Mpro抑制剂开发提供了新骨架和新策略。
北京大学博士研究生刘明、助理研究员李吉辉博士、深圳市第三人民医院刘文齐博士(张国良团队)、北京大学博士研究生杨颖为该工作共同第一作者。为本文做出贡献的还有北京大学张曼曼、朱雯宁,叶宇鑫博士、清华大学蛋白质研究技术中心周翠燕博士、北京大学翟宏斌教授。该工作得到国家自然科学基金、深圳市科技项目等基金的大力支持。
论文信息:
The S1’-S3’ Pocket of the SARS-CoV-2 Main Protease Is Critical for Substrate Selectivity and Can Be Targeted with Covalent Inhibitors
Ming Liu,† Jihui Li,† Wenqi Liu,† Ying Yang,† Manman Zhang, Yuxin Ye, Wenning Zhu, Cuiyan Zhou, Hongbin Zhai, Zhengshuang Xu,* Guoliang Zhang,* Hao Huang*
Angewandte Chemie International Edition, DOI: 10.1002/anie.202309657
