两篇Science子刊背靠背|黄昊团队与合作者揭示人类冠状病毒木瓜样蛋白酶干扰先天免疫机制和致病性差异
2023年5月2日,北京大学深圳研究生院/深圳湾实验室/省部共建肿瘤化学基因组学国家重点实验室黄昊团队与合作者在Science Signaling上背靠背发表两篇研究论文分别揭示了新冠病毒木瓜样蛋白酶(PLpro)干扰人体先天免疫的机制,以及七种人类冠状病毒木瓜样蛋白酶(统称PLP)因去泛素化和去ISGylation酶活性而干扰人体先天免疫及致病性差异。
1. 新冠病毒PLpro去泛素化STING拮抗IFN-I免疫反应
黄昊团队联合深圳市第三人民医院/国家感染性疾病临床医学研究中心张国良团队在Science Signaling杂志上在线发表了题为“The SARS-CoV-2 papain-like protease suppresses type I interferon responses by deubiquitinating STING”的研究论文[1],揭示了新冠病毒PLpro去泛素化STING并阻断抗病毒信号传导机制。PLpro可以切割病毒蛋白链完成病毒组装,并且具有去泛素化酶活性,帮助病毒逃避人体抗病毒先天免疫反应。本研究揭示了PLpro通过特异性地去除干扰素基因刺激因子(STING)的Lys289位点K63连接的多聚泛素链,从而阻断STING与结合伙伴干扰素反应因子3 (IRF3)和核因子kappa-B激酶ε抑制剂(IKKε)的相互作用,导致下游I型干扰素应答的抑制。作者还尝试了将STING激动剂diABZi和PLpro抑制剂GRL0617联用,协同抑制新冠病毒在人肺细胞中的复制,这种同时抑制病毒的组装和提升人体抗病毒I型干扰素(IFN-I)免疫反应的尝试,为COVID-19的治疗提供了新的思路 (图 1)。
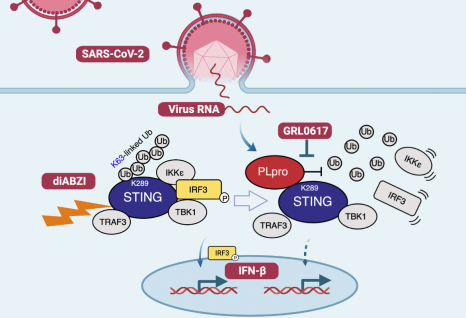
图1新冠病毒PLpro干扰人体先天免疫机制
该文章共同第一作者为北京大学博士生曹丹、深圳市第三人民医院的段炼博士(张国良团队)和北京大学深圳研究生院黄斌博士。为本文做出贡献还有北京大学博士生熊玉先。该工作得到了国家自然科学基金、深圳市科技项目、深圳湾实验室开放项目和广东省科学与技术项目等基金的大力支持。
2. 七种人类冠状病毒PLP去泛素化/去ISGylation酶活性差异与致病性关联
在同期Science Signaling杂志上,黄昊团队背靠背发表“The substrate selectivity of papain-like proteases from human-infecting coronaviruses correlates with innate immune suppression”[2],揭示了可感染人类的七种冠状病毒(HCoV-NL63, HCoV-229E, HCoV-HKU1, HCoV-OC43,SARS-CoV-2, SARS-CoV,和 MERS-CoV)各自编码的PLP对泛素和ISG15的底物偏好与冠状病毒致病性有关。
来自高致病性冠状病毒(包括SARS-CoV-2)的木瓜蛋白酶具有去泛素化和去ISGylation活性,使其能够干扰先天免疫信号通路。通过鉴定和表征弱致病性冠状病毒PLP的去泛素化和去ISGylation活性,本研究发现了七种PLP的酶学特性与致病性之间的关系。与高致病性冠状病毒(SARS-CoV-2, SARS-CoV,和 MERS-CoV)的PLP相比,弱致病性冠状病毒(HCoV-NL63, HCoV-229E, HCoV-HKU1,和 HCoV-OC43)的PLP有更强的去泛素化酶活性而不是去ISGylation活性。弱致病性冠状病毒HCoV-HKU1的PLP与泛素的复合物晶体结构揭示了这种底物偏好性的结构基础。尽管所有PLP都在不同程度上抑制先天免疫信号通路,但来自高致病性冠状病毒的PLP对先天免疫信号通路的抑制作用更强。这些差异可能导致冠状病毒在宿主免疫逃逸和致病性方面的差异(图2)。
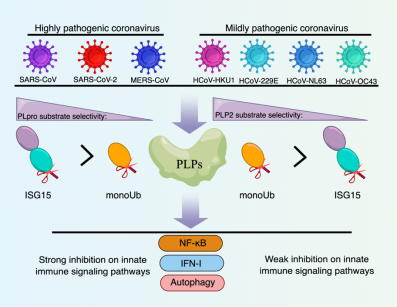
图2七种人类冠状病毒PLP的去泛素化酶/去ISGylation活性与致病性关联
北京大学博士研究生熊玉先和助理研究员黄斌博士为该工作共同第一作者。为本文做出贡献的还有北京大学杨颖、傅鑫铭、徐慧东、刘明、张曼曼、南方科技大学杨海滨、余聪教授,以及北京大学核磁中心的牛晓刚博士。该工作得到了国家自然科学基金、深圳市科技项目、深圳湾实验室开放研究项目等基金的大力支持。
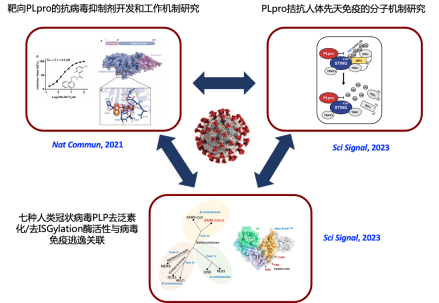
图3北大黄昊团队与合作者在冠状病毒木瓜样蛋白酶研究中获得系统性成果
在前期靶向新冠病毒PLpro的研究中,黄昊团队与深圳第三人民医院/国家感染性疾病临床医学研究中心张国良团队还曾经获得抗新冠病毒小分子抑制剂GRL0617,并解析了PLpro和GRL0617的复合物晶体结构,揭示了GRL067的工作机制(Nat Commun, 2021)[3]。黄昊团队与合作者目前在新冠病毒PLpro研究中,在化学生物学、免疫学和结构生物学领域做出了一系列的深入、系统的工作(图3),为抗病毒靶向药物研究提供了结构基础,对冠状病毒木瓜样蛋白酶介导免疫逃逸的分子机制进行了解析,并且为COVID-19提供潜在的疗法。
References:
1. Cao D, Duan L, Huang B, Xiong Y, Zhang G, Huang H.,The SARS-CoV-2 papain-like protease suppresses type I interferon responses by deubiquitinating STING, Sci Signal. 2023 May 2;16(783):eadd0082.
2. Xiong Y, Huang B, Yang Y, Fu X, Fu Z, Xu H, Liu M, Cao D, Zhang M, Yang H, Niu X, Yu C, Huang H., The substrate selectivity of papain-like proteases from human-infecting coronaviruses correlates with innate immune suppression, Sci Signal. 2023 May 2;16(783):eade1985.
3. Fu Z, Huang B, Tang J, Liu S, Liu M, Ye Y, Liu Z, Xiong Y, Zhu W, Cao D, Li J, Niu X, Zhou H, Zhao YJ, Zhang G, Huang H., The complex structure of GRL0617 and SARS-CoV-2 PLpro reveals a hot spot for antiviral drug discovery, Nat Commun. 2021 Jan 20;12(1):488.
