http://scbb.pkusz.edu.cn/content-869-1489-1.html
CD38作为细胞表面膜蛋白,目前在制药领域的重要性主要体现在两个方面:首先,多发性骨髓瘤等癌细胞上CD38的异常高表达使它成为良好药靶,人们利用它来识别并特异性杀伤相应肿瘤细胞,单克隆抗体DARZALEX®(Genmab)被美国FDA批准用于多发性骨髓瘤的单独用药治疗方案;其次,肿瘤浸润T细胞发生免疫抑制过程中CD38表达的激活,对CD38功能机制的深刻理解将有助于通过靶向该分子开发针对多种肿瘤的免疫疗法。
近日,我院李汉璋/赵永娟课题组在美国科学院院刊《PNAS》上在线发表题为” Cytosolic interaction of type III human CD38 with CIB1 modulates cellular cyclic ADP-ribose levels” 的研究论文(doi: 10.1073/pnas.1703718114),深入阐释了CD38在细胞内合成第二信使cADPR的分子机制,为CD38的生物学功能提供了新的见解;并为膜蛋白双重膜定向提供了研究方法及佐证。
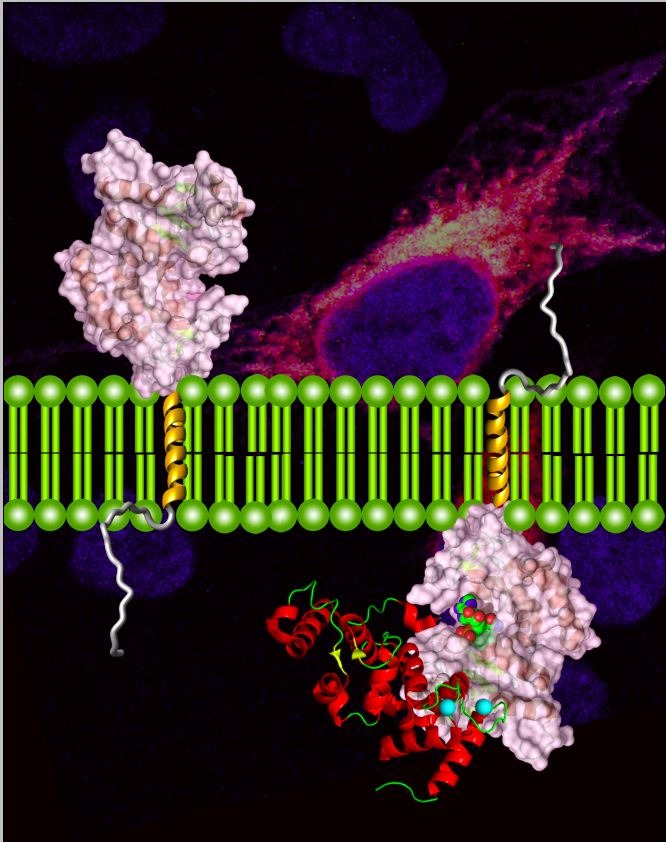
CD38是一个多功能膜蛋白,除了可能作为受体起作用外,它也被证明是细胞内负责代谢两个钙离子第二信使cADPR和NAADP主要的酶,它可通过调控细胞内钙离子浓度调控众多生物学功能。但是CD38催化cADPR代谢的机理一直未被阐明,因为CD38主要以 II型膜蛋白的形式存在,催化结构域位于胞外或细胞器内腔,而非 NAD通常所在的细胞质中。为了实现底物接触,一种假说依赖于转运蛋白;另一种更大胆的设想是,CD38的膜方向可以被调节,催化结构域位于细胞质的III型CD38可能是主要合成cADPR的形式。为了证明第二种猜想,李汉璋/赵永娟课题组不懈努力,已经从多个角度获得了支持证据,包括III型CD38的活性,用膜表面N端序列的免疫识别验证III型CD38的存在等。
由于不同膜方向的CD38在基因水平完全相同,且丰度上III型远远低于II型,要研究III型CD38十分困难。本研究中,他们开发了另一种高灵敏度、特异性针对III型CD38的鉴定方法(DepID),利用两个表达于细胞质、可同时结合于CD38催化结构域的纳米抗体(特异性),分别融合荧光素酶的N端和C端构建了PCA(protein-fragment complementation assay)系统,通过重组的荧光素酶活性(灵敏性)来定量III型CD38。应用这一策略,在多株多发性骨髓瘤细胞系中成功的检测到III型CD38 的存在,且其丰度存在差异显著,与细胞内cADPR含量呈正相关,而与II型CD38无明显相关关系。
DepID方法的实现,一方面验证了III型CD38 的天然存在,表明膜蛋白可以具有多于一种的膜定向,也为下游调控机制研究提供了坚实基础;另一方面,该方法为细胞内其他低丰度或低信噪比蛋白的检测提供了可借鉴的经验,具有较好的可移植性。
在鉴定并量化了细胞内III型CD38后,论文进一步研究了它的调控机制。通过酵母双杂交技术筛选到一个与CD38相互作用的蛋白——钙离子信号相关蛋白CIB1,通过免疫沉淀、双分子荧光互补技术以及ELISA等方法在细胞内及体外验证了二者的互作关系。利用基因敲低及敲除等技术,证实细胞内的cADPR水平与CIB1的蛋白丰度呈正相关的关系,表明CIB1调控细胞内CD38的活性从而影响cADPR的含量。对于细胞内CD38活性的调控以及信号通路的研究,为针对CD38进行药物开发指明方向。
本研究由刘隽博士以及多位课题组成员合作完成,以上工作得到了国家自然科学基金委员会和深圳市科技创新委员会的资助。